qPCR实验操作流程
Q-PCR实验流程:
一、 ①实验前准备,每天早上到实验室后,先把超净工作台的紫外灯打开15-20分钟。②超净台前做实验,需佩戴干净的橡胶手套/一次性薄膜手套,RNA 抽提需带口罩。③取EP管/枪头时需用镊子,不可以用使用过的手套直接取用。取完EP管/枪头后,袋子及时封好。④橡胶手套须放入超净台照射紫外,实验操 作过程中不得带出超净台,移液器在一天工作结束后调至最大量程,并用75%乙醇清洁移液器,枪头盒及超净台面。⑤实验进行的过程中或观看实验时,没有带口 罩不要在超净台前讲话。
二、 总RNA抽提
1)细胞培养皿中细胞样品用1*PBS洗两次后,用1ml枪将PBS吸干净,加入1ml Trizol (invitrogen)溶液,吹打混匀,并吸至1.5ml RNase free EP管中使细胞充分裂解,室温静置5min;
如使用组织样品,则先用液氮充分研磨组织样品,然后加入1ml Trizol (Invitrogen)溶液,混匀,室温放置5min使其充分裂解;(管盖与管壁都需标记样品名称)
2)加入200μl氯仿,剧烈振荡混匀30s,使水相和有机相充分接触,室温静置3-5min;(离心时离心管按顺序排放,离心完毕,离心管的顺序也按顺序排好,与第一步的顺序一致)
3) 4℃下,14,000g离心15min,可见分为三层,RNA在上层水相,移至另一个新的RNase free EP管;(用20-200ul的枪吸取上清,吸上清时,枪头应沿着液面上层吸取上清,枪头不可碰到、吸到中间层)
4)沉淀RNA:加入等体积异丙醇,轻柔地充分混匀(颠倒6-8次)(不应用振荡器混匀),室温静置10min;
5)4℃下,14,000g离心10min,收集RNA沉淀(如离心后仍不见EP管底部有沉淀,应将EP管放置在-80度冰箱过夜,继续在4℃下,14,000g离心10min,收集RNA沉淀),去上清;
6)用75%乙醇洗涤两次(12,000g离心5min)(加入乙醇后只需轻轻颠倒EP管即可,不用振荡器震荡或枪头吸打沉淀),超净台风干;沉淀不能过干或过湿,过干则不易溶解,过湿则乙醇残留。
7)视沉淀量加入适量DEPC水(至少15ul)溶解沉淀。
三、去基因组
使用RNase-free的DNase І(Promega),按以下体系配置反应液,37℃消化30min,65℃灭活10min。
RNA |
30 |
µl |
总体积 | 100 | µl |
然后按以下步骤操作:
1) 加入等体积的苯酚/氯仿,上下颠倒混匀,室温放置5min后, 14,000rpm离心15min,取上清。
2) 加入等体积的氯仿,上下颠倒混匀,静置分层后14,000rpm,离心15min,取上清。
3)加入等体积异丙醇,轻柔地充分混匀(颠倒6-8次),-20℃静置15min;
4)4℃下,14,000g离心15min,收集RNA沉淀,去上清;
5)用75%乙醇洗涤两次(12,000g离心5min),超净台风干;
6)加入适量DEPC水(至少15ul)溶解沉淀。
四、总RNA纯度和完整性检测
1)纯度检测:取1μl RNA样品50倍稀释,在核酸蛋白检测仪上测定OD值,OD260/OD280的比值大于1.8,说明制备的RNA较纯,无蛋白质污染。
2)总RNA完整性检测:取RNA样品1μl,1%琼脂糖凝胶电泳80V×20min,EB染色10min,用凝胶成像系统观察并拍照,总RNA的5s rRNA, 18s rRNA和28s rRNA条带,三条条带完整的话即可证明总RNA抽提比较完整。
五、逆转录
1、mRNA:
1) 在RNase free的PCR管中配置下列溶液:
Total RNA | 1.0 |
µg |
总体积 | 12 | µl |
2) 将上述溶液吹打均匀,置85℃保温5min,使RNA变性。随后立即冰上致冷, 以防止RNA复性;
3) 在该PCR管中加入下列试剂(Promega)
oligo(dT) |
0.5 |
µl |
总体积 | 8.0 | µl |
4) 将上述20μl反应溶液30℃保温10min;
5) 42℃保温50min;
6) 85℃保温10min;
7) -20℃保存。
2、microRNA:
使用茎环逆转录法,原理如下图:
1) 在去RNase的PCR管中配置以下溶液;
total RNA |
1.0
|
µg
|
总体积 | 12.5 | µl |
2)将上述溶液混匀,85℃孵育5min,以打开RNA二级结构。随后立即置于冰上,以防止RNA复性再次恢复二级结构;
3) 在另一去RNase的PCR管中配置以下溶液:
10mM dNTP (promega) |
2.0 |
µl |
总体积 | 7.5 | µl |
4) 将3)溶液加入到1)溶液中,混匀后30℃保温10min;
5) 42℃孵育50min;
6) 85℃孵育10min灭活逆转录酶。
六、定量PCR检测
1、引物测试:
根据mRNA设计的引物正式实验前需进行qPCR测试其特异性和扩增效率,具体反应体系和反应条件如正式实验,每对引物需做模板水对照。
得到结果后,首先根据熔解曲线判断引物特异性,选择标准为:单峰且峰形偏窄、水对照无明显引物二聚体熔解曲线峰。若设计的多对引物熔解曲线均显示特异性良好,则应对比各引物的扩增曲线,优先选择Ct值小、扩增效率高的引物进行正式实验。
2、确定上机内容后,首先在记录本上编排好上机的样品排放顺序。
(1)一个样品的加样尽可能安排在同一行;
(2)如正式实验中三次重复不能安排在同一板上,则需把三次重复中的实验分开,但同一次重复的实验不能分开两板。
3、正式实验:
体系配制:
H2O 4ul
SYBR Green PCR Master Mix 10ul (TOYOBO)(使用前需振荡均匀)
上游引物 0.5ul (10uM)
下游引物 0.5ul (10uM)
总体积 15ul
计算好实验中需用多少份体系,则按具体量配置。体系分装会有损失,一般多配0.5份--1份体系。
总的体系配好后,在振荡器中振荡均匀或用枪吸打均匀,然后15ul每管分装至8连管中。
4、cDNA用灭菌纯水稀释适当的浓度,一般为1:20稀释,如遇到基因表达低的样品,则适当降低稀释比例至1:10或1:5。cDNA按一定顺序排好 后,即可加至刚配好的反应体系中。加样完毕,盖好八连管盖,并在八连管盖最上沿的边上标记好1-12的顺序(不可将标记写在反应管的盖子上,八连管盖避免 裸手触摸中间透明的荧光采集区域,且保证每孔均盖紧,否则影响重复性或可能出现熔解曲线峰漂移。)
5、把各排八连管放在掌上离心机上离心数秒。
七、上机:
7.1 先开电脑,进入Windows 界面。接着打开PCR仪电源开关。
7.2 打开7500软件,选择“新建”,在“Template”下拉菜单中选择“60”或“65”(普通基因检测为“60”,MicroRNA检测为“65”)。
7.3 打开样品架,放入八连管,关上样品架,并在软件上选择已放反应管的孔位,剔除无反应管的孔位。
7.4 点击File菜单中Save,输入要保存结果的文件名,命名为日期-上机时间-客户名字简写,如100830-1008-WL表示8月30日10点08分魏立的实验。
7.5 点击Start键,开始运行程序。
7.6 程序运行完毕后,取出样品架上的八连管,按顺序关闭ABI PRISM 7500 SDS 软件、PCR仪电源开关。
7.7 在7500软件上标记好每个反应孔的样品名称及检测基因的名称,分类保存好结果文件。
反应完成后,八连管应装到封口袋中,袋子上标记好文件名,客户的名字。(同一个客户的三次重复实验,则只需保存其中一次重复的反应管即可,其余可丢弃)
iCell-CRO实验外包服务介绍:
一站式细胞解决方案
针对基础及临床研发中的原代细胞和iPS细胞的实验,由于原代细胞的分离和培养难度大,iPS细胞制作和分化的实验操作复杂,除长期进行原代和iPS培养工作的实验室,想要获得足够量的状态好的细胞比较困难。
赛百慷依靠多年在细胞培养方面的积累,为客户提供完整的细胞CRO解决方案。根据客户需求,直接在细胞水平进行药物或者试剂的刺激,观察细胞状态的变化或者特定通路上mRNA或蛋白的变化,也可以先制作动物模型,对动物进行处理后,分离特定的原代细胞进行需要的检测。
同时,我们可以依照客户提供的具体实验方案进行操作,也可以根据客户要求进行实验设计,并根据客户实验的规模和难度提供详细的报价和实验周期规划。
服务项目:
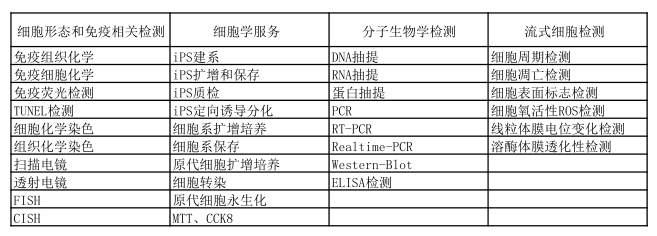
服务流程:
1.联系我们,沟通客户实验计划及目标,评估实验的的可行性。
2.依照客户要求,设计相应的实验;或客户已有实验方案发送给我们,我们研究方案的可操作性。
3.确定最终的实验方案,报价和周期。
4.签订服务合同,支付预付款。
5.开始实验服务,并定期向客户反馈和交流。
6.实验完成,提供完整实验说明和部分实验结果。
7.支付尾款,向客户提供完整的全部实验报告和原始数据。
8.项目完成。
咨询电话400-021-2021

