将药物进行有效的靶向递送仍然是现代医学的一个瓶颈问题。细胞外囊泡(EVs)作为一种由细胞释放的纳米级双层脂质颗粒,具有传递生物活性分子,参与细胞间通讯,调节近远端细胞反应的能力。相比合成纳米颗粒,EVs具有出色的生物相容性、稳定性和低免疫原性,并且表面存在可修饰位点增强其功能性,具有开发成纳米药物递送平台的潜力。然而EVs在体内半衰期短、非靶向性递送、药物装载量有限等问题仍然是开发EVs药物递送系统亟需克服的难点。
近日,研究人员展示了生物化学工程方法改善细胞外囊泡对细胞的靶向和荷载。
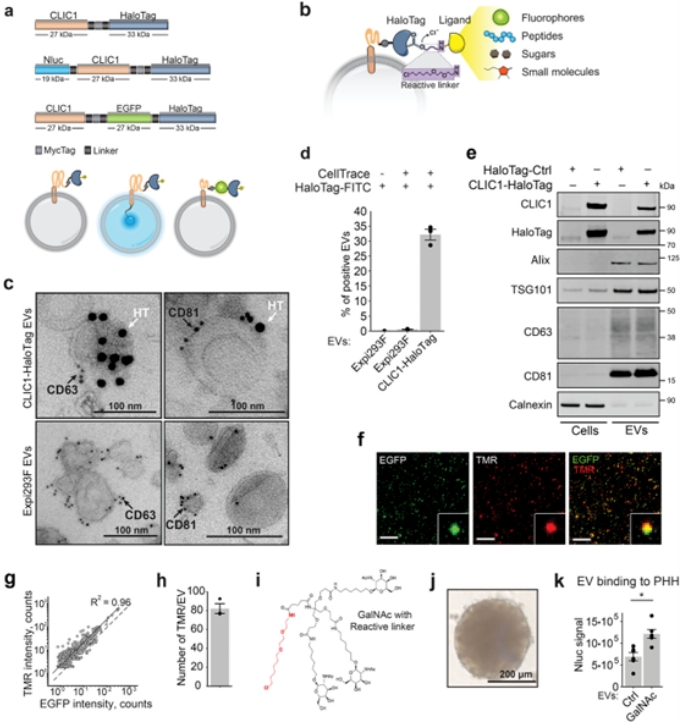
研究人员通过使用工程化的锚蛋白HaloTag与靶向配体如GalNAc进行融合并在EVs表面展示,成功实现EVs对人原代肝细胞的靶向。此外,研究人员还使用锚蛋白与能够识别GLP1细胞表面受体的抗体结合,证实该EVs能够识别并靶向过度表达GLP1受体的细胞。
研究人员最后还改善了Cre重组酶装载到EVs腔室中的效率。在经过内体逃逸增强剂处理后将功能性Cre递送到受体细胞的细胞质中,EVs的基本性质保持不变。注射到小鼠体内,经过改造的EVs耐受性良好,并且没有显示出可检测的肝毒性。表明EVs可以经过工程改造,改善荷载物负载和特定细胞靶向性,从而有助于将它们转化为定制的药物递送载体。
综上,该研究展示了生物工程化的EVs作为独特的靶向蛋白治疗药物递送系统的独特潜力,在精准靶向和装载量上取得新进展。


