研究揭示人源细胞中核纤层蛋白lamin B1对染色质高级结构及运动状态的调控机制
作者:互联网
日期:2020-11-12
细胞核内DNA完全展开长达2米,而一般细胞核的直径仅有10-20微米,因此基因组在细胞核内处于高度折叠的状态,同时不断发生运动变化。染色质的三维结构具有有序性和动态变化性,构成细胞核中各种生物学过程的全新调控层次。通过成像和高通量测序技术,研究者发现染色质高级结构分为染色质环(Loop)、拓扑关联域(Topologically associating domain,TAD)、A/B区室(A/B compartment)和染色体领地(Chromosome territory,CT)等多个层级。但是,研究者对于隔离与定位A/B区室和染色体领地的调控因子与机制认知较少,同时对影响染色质运动状态的因素了解有限,例如染色质高级结构与运动状态的关联性尚不清楚。
已有对染色质高级结构和运动状态的研究结果提示,细胞核核膜附近的核纤层区域对染色质的结构和运动状态维持、相应基因表达调控均有重要作用。在核膜内层,核孔复合体和跨膜蛋白结合在由核纤层蛋白组成的网状结构上,共同组成核纤层。核纤层蛋白包括两类:A型核纤层蛋白(lamin A和lamin C)和B型核纤层蛋白(lamin B1和lamin B2)。近期,已有多个课题组分别报道了在拟南芥1、线虫早期胚胎2、果蝇细胞3和小鼠胚胎干细胞4中核纤层蛋白对染色质高级结构的影响,这些研究结果既有共同特征也有差异性,但尚无在人源细胞中的报道。
北京大学生物医学前沿创新中心(BIOPIC)孙育杰课题组与北京大学生命科学学院李程课题组合作结合三维基因组组学技术和多种细胞核内标记成像技术,特别是对活细胞单染色质位点的标记追踪,揭示了在人源细胞中核纤层蛋白lamin B1对染色质高级结构及运动状态的调控机制。
研究者首先通过免疫荧光技术标记不同染色质紧密状态的表观遗传修饰5,发现在lamin B1蛋白敲除的人乳腺癌细胞系中,对应染色质松散折叠状态的H3K4me2、H3K4me3和H3K27ac修饰整体含量有显著性增加,而对应紧密折叠状态的H3K27me3修饰的核内分布由富集于核膜附近变化为分散于核质中。
研究者进一步用荧光原位杂交(chromosome painting)标记了2号、18号和19号染色体,通过测量染色体的体积和细胞核内径向分布,在单条染色体层面验证了lamin B1蛋白敲除对染色质整体的解压缩和重排布。随后,作者通过lamin A的ChIP-seq测序,鉴定了lamin B1敲除细胞中核纤层关联域(Lamina-associated domain,LAD)的变化。
研究发现LAD的数量虽然有所增加,但是其基因组覆盖度和长度中位数均减小,提示部分LAD脱离了核纤层。Hi-C测序数据显示,敲除lamin B1蛋白导致染色体之间及A/B区室之间的相互作用增加,表明lamin B1蛋白参与维持染色体领地和A/B区室的正常隔离。此外,敲除lamin B1蛋白对TAD的位置和结构无明显影响。
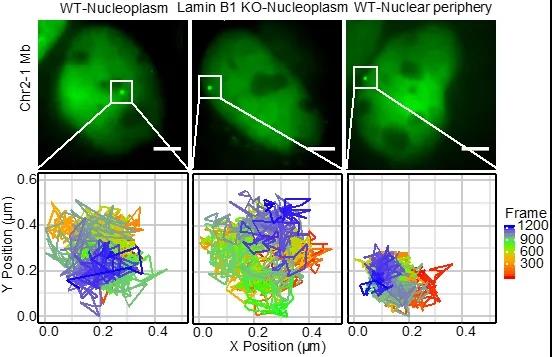
为进一步在活细胞中研究lamin B1蛋白对染色质的调控,研究者利用CRISPR-SunTag活细胞单基因位点标记技术6,发现敲除lamin B1蛋白后,不仅使倾向于分布在核膜附近的染色质位点分布在核质中的比例增加,还会使染色质位点的受限扩散运动加快。
研究者进一步对染色质位点运动数据进行分析,发现在野生型细胞中,同一个染色质位点定位于核膜附近区域时的运动相比定位于核质区域时的运动更加受限。而在lamin B1蛋白敲除的细胞中,同一个染色质位点定位于核质区域时的运动相比于在野生型细胞中定位于核质区域时的运动加快,证明lamin B1参与限制核质内染色质的运动。作者推测,受到lamin B1调控的染色质折叠状态可能是影响染色质运动的重要因素。
为证明这个猜测,研究者使用去乙酰化酶抑制剂TSA处理野生型细胞,使染色质上的乙酰化修饰增加,发现染色质整体折叠状态变得松散,同时染色质运动增强。最后,作者标记了5个位于A区室的染色质位点和5个位于B区室的染色质位点,发现位于B区室的染色质位点的运动相比位于A区室的染色质位点运动受限,证实了染色质高级结构与运动状态的关联,支持了染色质空间位置和折叠状态对其运动状态的影响。
综合以上结果,研究者提出核纤层蛋白在核膜附近帮助锚定核纤层关联域的染色质,从而为染色质在核内的分布提供牵引力的模型。敲除lamin B1蛋白会使部分位于核膜附近的染色质向核质中转移,同时使染色质折叠趋于松散,有更大的自由度,从而运动速度和运动范围增加;染色质在核内的分布变化和解压缩影响了染色质领地和A/B区室正常的隔离状态,使染色质高级结构发生一定混乱。
同行前期的研究发现,核质中对染色质的作用力可能来自于细胞核内的核骨架蛋白及其相关蛋白,如HNRNPU7等。结合这些发现,作者提出了维持染色质空间结构的“拔河模型”:核纤层蛋白作为边缘核骨架组分,为染色质高级结构的维持提供了与核内核骨架相反的牵引力,像两支队伍之间的拔河,共同组织和维持染色质在细胞核内的正常分布和运动状态。


