Cpeb1b介导的细胞质多腺苷酸化调控造血干祖细胞发育机制
作者:互联网
日期:2023-09-15
在脊椎动物胚胎发育过程中,次级造血(definitive hematopoiesis)过程可以产生造血干祖细胞(HSPC)。而HSPC具有产生所有谱系血细胞和维持机体终生血液系统的能力。在次级造血时期,哺乳动物主动脉-性腺-中肾区或斑马鱼背主动脉腹侧壁区域中的一部分内皮细胞接受细胞内、外信号,获得造血潜能,成为生血内皮细胞。
这些生血内皮细胞逐渐改变自身形态,由扁平变为球形,并从背主动脉脱离出来最终转变为HSPC。然而,这些内皮细胞如何被精确调控以进行内皮-造血的命运转变尚未完全清晰。
近日,研究人员报道了Cpeb1b介导的细胞质多腺苷酸化调控造血干祖细胞发育机制,为内皮细胞进行内皮-造血的命运转变提供了新线索。
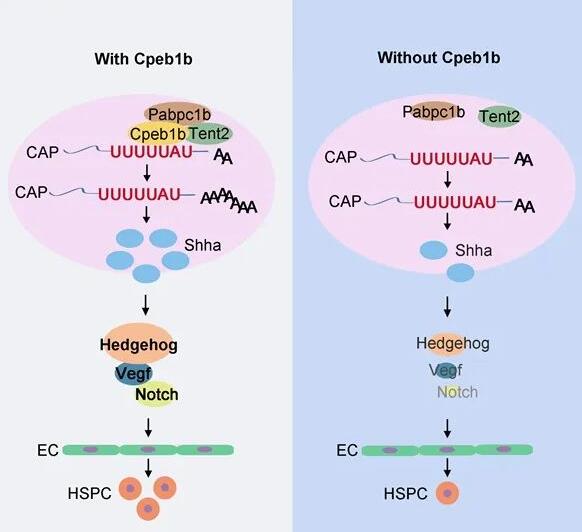
CPEB家族蛋白参与多种生物学过程的调控,包括突触可塑性、生殖细胞特化、细胞衰老和肌肉干细胞激活等。研究人员发现Cpeb1b介导的细胞质多腺苷酸化在斑马鱼次级造血过程中通过调控Hedgehog(Hh)信号对HSPC产生重要作用。
Cpeb1b缺失胚胎的次级造血过程中HSPC的产生减少,且HSPC减少由生血内皮细胞特化缺陷导致。进一步研究发现,Cpeb1b介导的shha mRNA胞质多聚腺苷酸化能增强其翻译效率,从而提高Shha蛋白水平。Shha蛋白通过激活Hedgehog-Vegf-Notch信号轴来促进生血内皮细胞的特化,进而维持正常的HSPC产生过程。
综上,该研究揭示了Cpeb1b介导的细胞质多腺苷酸化在HSPC发育中的作用,并为转录后调控如何高保真地引导发育信号将其转化为细胞命运转变提供了见解。


