研究发现一种工程化的去核间充质干细胞递送系统构建方法
作者:互联网
日期:2023-08-22
细胞白介素-10(IL-10)和IL-12等细胞因子具有强大的免疫调节功能和治疗各种疾病的潜力,包括急性胰腺炎、炎症性肠病和癌症。然而,它们在循环中的半衰期短、在靶组织中的生物利用度低以及与全身给药相关的不良反应阻碍了临床使用。
随着多种靶向递送系统的开发,包括基于纳米技术的药物递送系统、抗体-药物偶联物和仿生递送方法,已经在一定程度上改善了药物递送的局限性并提高治疗效果。
其中开发的无细胞递送载体(CFDV)如细胞外囊泡(EV)、基于红细胞载体和细胞膜衍生载体等缺乏能够产生能量、激活高亲和力整合素介导的内皮粘附、克服化学梯度和产生推进力所需的关键细胞器和关键细胞机制。因此,CFDV既不能通过血管屏障主动趋化,也不能响应化学信号将自身推进到复杂的组织深处。
近日,研究人员报道了一种工程化的去核间充质干细胞递送系统构建方法。
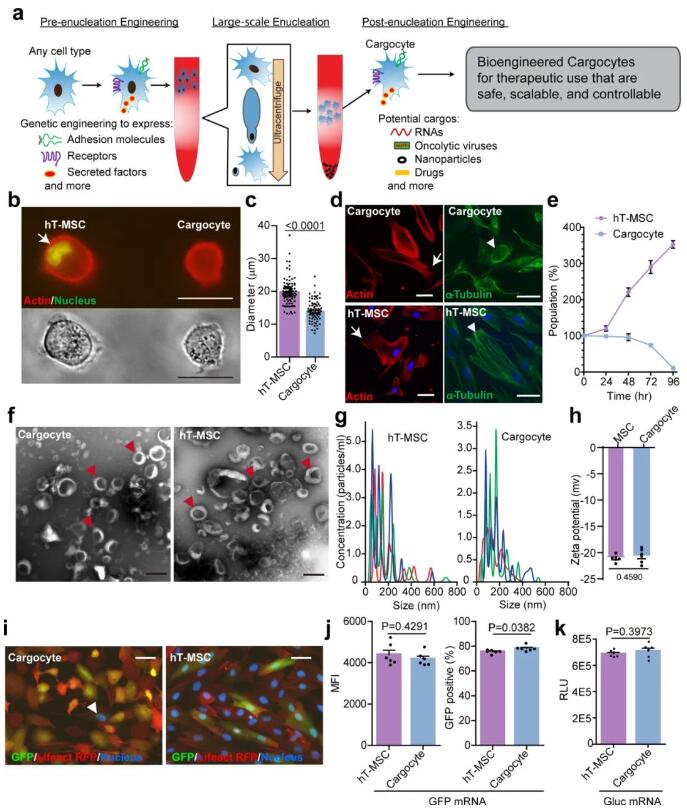
MSCs具有内在的疾病靶向和旁分泌能力,作为治疗性载体获得了大量的关注。研究人员使用生物工程技术赋予MSCs可介导炎症和患病组织归巢的多种趋化受体和内皮细胞粘附分子。为使生物工程MSC安全可控,使用密度梯度离心去核来产生一种新型的疾病归巢CFDV,将其命名为“Cargocytes”。
Cargocytes保留了重要的内在细胞功能,例如蛋白质翻译和分泌、向确定的趋化因子信号的主动趋化迁移以及体外调节的高亲和力整合素激活和内皮细胞粘附。在两种疾病动物模型中,证明了生物工程化的细胞能够有力地归巢并将治疗性细胞因子货物输送到患病组织,从而改善疾病病理。
综上,该研究开发的生物工程化的Cargocytes使用主动趋化性和内皮粘附来有效且特异性地将治疗性货物输送到目标组织,丰富了靶向递送系统递送功能。


