小细胞肺癌(SCLC)是一种侵袭性神经内分泌(NE)恶性肿瘤,占据肺癌约13~15%,以快速倍增,早期转移和预后不良为特征,5年生存率不足7%。这些患者当中70%出现扩散,只能接受全身治疗。
目前针对SCLC的临床治疗手段主要是依赖以铂类药物为主的化疗或者化疗/免疫疗法的联合。由于免疫治疗较低的临床应答率,目前以DNA损伤药物为主的化疗依旧是转移期SCLC全身疗法的重要支柱。然而,SCLC强大的获得性耐药能力使得化疗不仅起效短暂且容易复发。但导致SCLC获得性耐药的机制依旧扑朔迷离。
近日,由美国德州大学西南医学中心Benjamin J. Drapkin和美国麻省综合医院癌症中心Nicholas J. Dyson领衔的研究团队表明部分患者复发的SCLC中跨损伤DNA合成 (TLS) 的上调可以诱导此类患者对联合OT(PARP抑制剂奥拉帕利联合DNA烷化剂替莫唑胺)引起的DNA复制损伤的耐受。
这是导致SCLC产生获得性耐药性的关键因素,而使用TLS抑制剂可以克服这种耐药性。研究发现的TLS 的上调是在 SCLC 患者的肿瘤细胞中鉴定出的第一个与获得性耐药有关的特定分子机制。
DNA损伤药物作为SCLC全身治疗的主流药物面临着快速且短暂的药物反应。随着连续复发,在治疗中获益的患者比例显著下降。SCLC肿瘤也从单纯的药物响应状态逐渐演变为获得性耐药状态。
参考转移性NSCLC治疗的成功范例可知[9],在复发时,重新对肿瘤样本活检可以比较治疗前和复发后样本,以了解获得性耐药机制的概况并开发克服耐药性的疗法。
相比之下,由于再次活检在SCLC中缺乏临床意义,所以配对的治疗前/复发后肿瘤样本极为罕见。而已获得的少数复发后样本或是经过固定的,或是经过冷冻的。这些复发后样本无法用于确认具体的耐药变化,这导致大部分对于SCLC的耐药性研究只能基于假设。
另外,关于SCLC对DNA损伤药物的耐药性研究缺乏临床相关性模型。实验室药物方案通常在剂量和时间上与临床给药不同,并且在复发后患者的样本或模型中未得到证实的情况下,尚不清楚这些实验系统能否很好地模拟临床耐药性。总的来说,目前尚未对SCLC的获得性耐药达成共识或找到临床上可行的机制
基于以上问题,使用多个临床时间点中SCLC患者的循环肿瘤细胞,活检和积液样本作为肿瘤来源建立了患者来源的异种移植(PDX)模型,治疗前/复发后匹配的PDX对用以发现化疗耐药机制。
进行了一项单臂1/2期临床试验,对SCLC复发患者联用PARP抑制剂奥拉帕利与DNA烷化剂替莫唑胺(联合OT)。
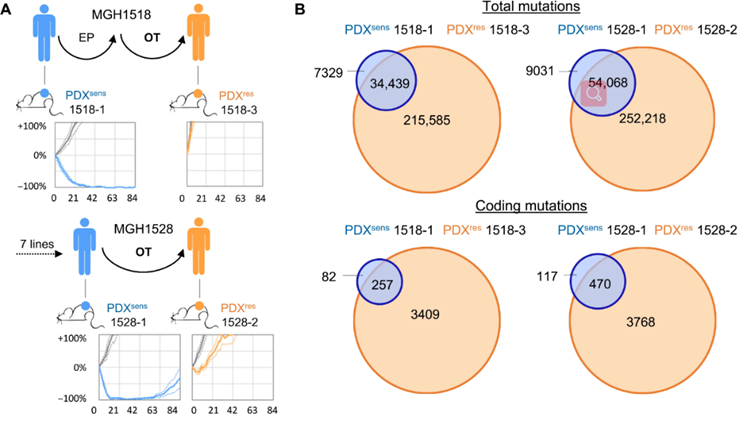
从对OT试验具有持久反应的两名患者(MGH1518 和 MGH1528)中获得了OT治疗前和OT后复发PDX模型,用以模拟从临床敏感性到获得性耐药的转变。其中,对OT高度敏感的预处理PDX模型,称为PDX sens 1518和PDX sens 1528。而对OT具有高度耐药性的模型,称为PDX res 1518和PDX res 1528。
研究人员利用全基因组测序证实了这些肿瘤中的高突变负担。然而,这种突变负担的大量增加几乎都与治疗相关,导致难以从遗传谱中发现耐药机制。
研究对OT耐药SCLC进行奥拉帕利和替莫唑胺(TMZ)药效实验,发现对于OT获得性耐药SCLC,奥拉帕利抑制PARylation或TMZ引起DNA损伤的能力没有显著差异。
然而,彗星实验和γH2AX免疫检测证明OT在两种MGH1518模型中均诱导单链DNA断裂(SSB),但PDX res 1518不再将OT诱导的SSB转化为双链DNA断裂(DSB)。这些结果表明OT烷基化DNA并抑制蛋白质PARylation从而在两种模型中诱导SSB,但在PDX res 1518中,获得性耐药机制阻止了DSB和γH2AX病灶的积累。
由于SCLC对DNA损伤药物的敏感性随细胞周期进程而变化,奥拉帕利和TMZ对S期的细胞具有更强的细胞毒性。
研究通过肿瘤组织免疫检测和scRNA测序发现:PDX res 1518比PDX sens 1518中有更多的细胞处于G1期。作者由此假设这种细胞周期分布可能有助于SCLC对OT产生获得性耐药并建立了以下模型以揭示OT的即时和延迟细胞效应。
PDX sens 1518和PDX res 1518均在体内给予单剂量的奥拉帕利和TMZ,并在治疗4或24小时后切除肿瘤。在PDX sens 1518中,受损细胞或在G2期中积累或未能完成DNA复制;而在 PDX res 1518中,几乎所有的DNA 损伤都集中在S期群体中。
此外,前者中每个细胞的增殖能力发生进行性下降,并且在治疗5天后,几乎所有肿瘤细胞都无法增殖。相反,后者增殖能力在给药1天后基本不受影响,在治疗3天和5天后反而增加。这些结果表明PDX res 1518细胞中G0或G1期细胞对OT具有耐药性,并且可以在治疗期间和治疗后促进肿瘤生长。
随后,研究人员在短期培养的PDX细胞中探究了,是否进行OT治疗情况下的DNA复制动力学。在未经处理的MGH1518模型中,复制叉速度相似,但在OT存在时它们出现差异,即:在PDX sens 1518细胞中DNA复制逐渐减速,而PDX res 1518细胞几乎没有变化。
从理论上讲,因为没有诱导损伤,PDX res 1518中的复制叉可能对OT不敏感,但前文中对OT处理的细胞的碱性彗星测定表明情况却与此不符。因此,猜想复制叉可以通过TLS等耐受机制暂时绕过OT诱导的损伤,即:高保真复制DNA聚合酶被可以绕过DNA损伤的低保真TLS聚合酶取代。
研究在TLS 抑制剂(TLS pp)的存在下重复DNA纤维测定,结果表明:单独使用TLSpp治疗减慢PDX res 1518复制叉的效果较弱,但与OT结合使用,其导致复制叉明显减速。随后,测试了 TLS 抑制使SCLC模型对OT重新敏感的能力。与预期相符,在体外抑制TLS使PDX res 1518细胞对OT敏感。
此外,在SBC-5、COLO-668、NCI-H82、NCI-H2029、SW1271、DMS53、NCI-H526和NCI-H841等SCLC的细胞系上使用OT + TLS pp的组合均比单独的OT更有效。
而MGH1528模型则表现出不同的耐药机制,尽管PDX res 1528表现出对OT的获得性耐药,但PDX sens 1528和PDX res 1528对由OT和γ射线辐照诱导的DSB没有差异;此外,OT对PDX res 1528更弱的DNA损伤能力与细胞周期所处阶段无关;最后,使用TLS抑制剂亦不能使得耐药细胞更敏感。
以上均表明PDX res 1528与PDX res 1518通过不同的机制对OT产生获得耐药性。这也反映了SCLC的异质性及其获得性耐药机制的复杂性。
研究构建并比较了来自治疗反应性患者的治疗前和复发后PDX模型,鉴定出TLS上调和/或过度激活赋予SCLC对DNA损伤药物的获得性耐药,并且在部分情况下,通过添加TLS抑制剂可以部分恢复SCLC对OT的敏感性。此外,这种连续肿瘤采样的方法有助于在临床中诊断SCLC获得性耐药机制,据此可能提供活检所需的临床生物标志物,从而绕过或消除这种耐药机制。


