研究揭示NETO2调控Kainate受体脱敏和整流过程的分子机制
作者:互联网
日期:2021-09-24
神经递质是在突触传递中担任“信使”的特定化学物质。大脑中存在上百种神经递质,对维持机体的正常生理功能发挥重要作用。谷氨酸是中枢神经系统中含量最高、分布最广的兴奋性神经递质,在大脑的信息筛选、过滤、储存以及认知和学习等方面起到关键作用。离子型谷氨酸受体包括NMDA受体、AMPA受体和Kainate受体,是配体门控的离子通道,通过结合谷氨酸从而调控通道的开闭状态。
Kainate受体作为三大离子型谷氨酸受体之一,与学习、记忆以及感觉信号转导等过程相联系,且与许多神经性系统疾病的产生相关。与AMPA受体和NMDA受体不同,Kainate受体在突触前和突触后膜均存在,在控制神经递质释放和神经递质信号传导中均发挥重要作用。大脑中,Kainate受体的突触定位及通道性质受到NETO家族蛋白的严格调控,但该调控的分子机制尚不清楚。
中国科学院生物物理研究所研究员赵岩课题组/张凯课题组,与南京大学模式动物研究所教授石云课题组合作研究首次解析了GluK2-NETO2复合物抑制剂结合的关闭状态以及激动剂结合的脱敏状态结构,并结合电生理功能实验验证,揭示了NETO2调控Kainate受体脱敏和整流过程的分子机制。
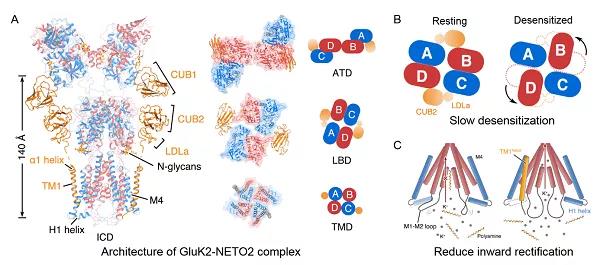
Kainate受体GluK2形成四聚体的通道结构,包括氨基末端结构域(ATD)、配体结合结构域(LBD)和跨膜结构域(TMD)。复合物结构显示,NETO2以化学计量比1:4或2:4结合在GluK2四聚体的一侧或两侧。辅助亚基NETO2具有可溶的CUB1、CUB2、LDLa结构域以及一个跨膜螺旋TM1,分别与受体的ATD、LBD和TMD相互作用。
电生理实验表明,任意一处相互作用位置的突变均会影响NETO2调控受体的活性。尤其是破坏ATD-CUB1的相互作用,NETO2将彻底失去调控受体活性的功能,这为理解AMPA受体和Kainate受体中ATD结构域的功能提供了新线索。
此外,谷氨酸受体还具有不同程度的内向整流(Inward rectification)特性。谷氨酸受体的整流特性主要由细胞内的多胺(Polyamine)介导。当膜电位为正时,带正电的多胺从细胞内测阻塞通道,从而降低通道的离子通透性。在本文中解析的GluK2-Neto2复合物胞内侧,研究人员观察到一个全新的胞内结构域(ICD),NETO2跨膜螺旋稳定了GluK2的ICD,该结构域阻碍多胺靠近通道,从而减弱了通道的整流效应。电生理实验表明,AMPA受体与Kainate受体的内向整流效应都受到相似结构域的调控。


