产品描述
本产品为iCell团队精心优化的间充质干细胞成脂诱导分化试剂盒,可增强间充质干细胞向成脂细胞分化的能力。
本产品仅用于科研用途,不可用于诊断、治疗、临床、家庭及其他用途。
产品组成成分及保存
试剂名称 | 体积 | 保存条件 | 有效期 |
地塞米松 | 200μL | -20℃ | 1 Year |
IBMX | 200μL | -20℃ | 1 Year |
罗格列酮 | 200μL | -20℃ | 1 Year |
胰岛素 | 400μL | -20℃ | 1 Year |
谷氨酰胺 | 2mL | -20℃ | 1 Year |
双抗 | 2mL | -20℃ | 1 Year |
胎牛血清 | 20mL | -20℃ | 1 Year |
基础培养基 | 200mL | 2-8℃ | 1 Year |
油红O贮存液 | 5mL | 2-8℃(避光) | 1 Year |
Ø 注意:
1.为保证产品的有效性,请避免反复冻融。
2.配制好的诱导培养基保存于2-8℃,有效期为2周,请根据实验用量合理配制。
产品使用说明
1. 成脂诱导分化完全培养基的配制
①室温条件下融化各因子及血清。各因子融化后,瞬时离心,使溶液集中于离心管底部。(注意:若因子或血清中有沉淀物,属正常现象,无须过滤,避免成分丢失。)
②根据实验用量,于无菌操作台中配制诱导分化完全培养基,建议每次配制50mL,配制比例见下表:
试剂成分 | 配制比例 | 50mL配制体系 |
地塞米松 | 0.1% | 50μL |
IBMX | 0.1% | 50μL |
罗格列酮 | 0.1% | 50μL |
胰岛素 | 0.2% | 100μL |
谷氨酰胺 | 1% | 500μL |
双抗 | 1% | 500μL |
胎牛血清 | 10% | 5mL |
基础培养基 | 补充至所需体积 | 补充至总体积为50mL |
2. 成脂诱导分化实验步骤
①建议取第3~5代、纯度达90%以上、状态良好的间充质干细胞,将其消化下来,离心收集,使用间充质干细胞完全培养基调整细胞密度为1~5×105个cell/mL,均匀铺于6孔板中,每孔2mL,置于37℃恒温细胞培养箱中培养。
(注意:此处细胞密度及培养液体积以6孔板为例,若为其它培养器皿,请根据实际情况调整细胞密度及培养液体积。)
②待细胞汇合度达80%~100%时,即可进行诱导分化。
③小心吸弃细胞培养上清,沿孔壁缓慢加入提前配制好的诱导分化完全培养基,每孔2mL,置于37℃恒温细胞培养箱中培养。
(注意:完全培养基加入细胞前需提前置于37℃预热。)
③每2day换用新鲜的诱导分化完全培养基。换液时,若细胞培养上清颜色变为澄清的黄色,是由于细胞量较大,培养基消耗较快导致的,请及时调整为每日换液。
(注意:完全培养基加入前需提前置于37℃预热。)
④细胞诱导3周后,即可进行油红O染色鉴定。
3. 油红染色分析
①细胞诱导分化结束后,小心吸弃细胞培养上清,1×PBS润洗1~2次。每孔加入1mL细胞固定液(4%中性甲醛溶液等),室温固定30 min。
②配制油红O工作液:油红O贮存液与蒸馏水按照3:2配制,(例:油红O贮存液3mL,蒸馏水2mL),混匀。使用滤纸过滤,收集滤液,即为油红O工作液。
(注意:成脂细胞内的油滴极易脱落,操作时须谨慎。)
③细胞固定完成后,吸弃细胞固定液,1×PBS润洗2次。沿孔壁缓慢加入油红O染色液,每孔1mL,室温染色30min。
(注意:油红O工作液底部可能会有沉淀,吸取时尽量不要触及底部。若细胞染色后有沉淀,PBS洗去即可。)
④吸出染色液,PBS润洗,去掉浮色。显微镜下观察细胞染色效果。细胞内油滴着色,呈红色。
(注意:油红O工作液不可重复使用,不建议回收。) 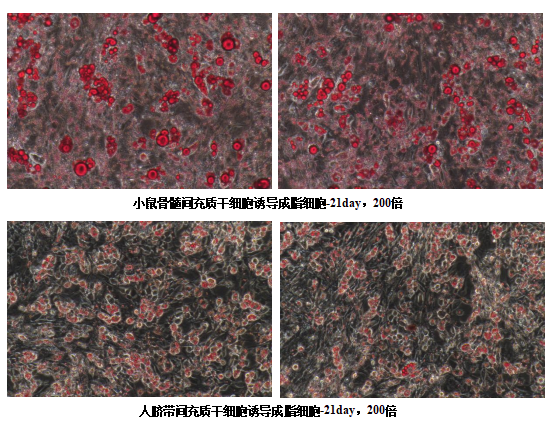
质量控制
ü 无菌检测(细菌、真菌和支原体检测)
ü pH测试
ü 渗透压检测
ü 内毒素
相关产品
l iCell间充质干细胞
l iCell原代间充质干细胞无血清培养体系,货号:PriMed-iCell-012-SF
l PBS缓冲液,货号:iCell-0800
仅限科研用。
培养体系中的一些组分是对人体健康有害的物质,请不要用暴露的皮肤接触培养体系的液体和有培养体系的液体残留的容器内部;这部分有害物质的浓度和危害性都较低,如有接触,立即用自来水冲洗即可。
你可能感兴趣
评价 (0)
留言板

